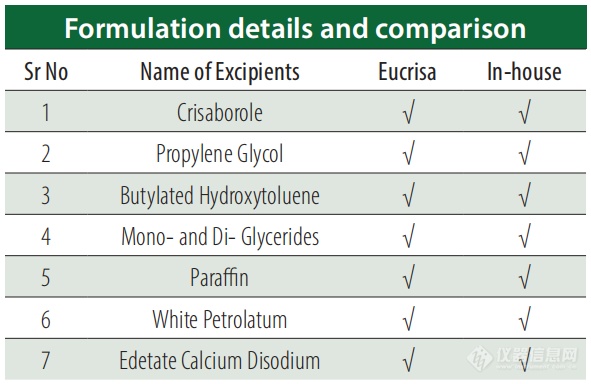
江南电竞网页版登录
江南电竞网页版登录中被确立为规范程序,该章节描述了测试程序、设备和统计方法,以证明产品的相似性或一致性)的推荐表征方法,这一些方法可以用来识别拟议中的仿制(测试)局部用药剂型,并描述可能对其性能至关重要的药物产品属性,以支持在比较两种局部用药产品的
方法作为附加措施来证明产品相似性产生了极大兴趣,这在简化新药申请(ANDA
已发布针对Crisaborole 2%的产品特定草稿指南[6]。欧洲药品管理局(EMA)也发布了一份关于使用IVRT程序来评估产品质量和支持局部用药产品等价性的指导文件[7,8,9]。二、
Crisaborole 认证参考标准品购自 Sigma Aldrich。高效液相色谱(HPLC)级乙腈和乙醇(95%)购自 Cole Parmer。Eucrisa(2% Crisaborole)的参考上市药物(RLD)从当地药房购买,批号为 SDAF;有效期至2024年3月。该产品由辉瑞公司分销。特别在实验室生产了含有标签上标示量的50%、100%和150%的Crisaborole(2%)的局部用产品,用作测试产品,并标识为Crisaborole(2%)。这一些产品由一名经过良好培训的科学家在印度孟买斯瓦米·维韦卡南达教育协会(VES)药学院实验室内,在一位经验比较丰富的药学教授的监督下制造。本研究工作的部分分析也是在同一设施内进行的。
RP-HPLC)通过内部验证的高效液相色谱系统(岛津科学,型号LC-2010)来测定IVRT样品中的Crisaborole浓度。该系统配备了光电二极管阵列(PDA)检测器,并于2023年8月重新校准。整个研究过程中使用了Kromasil C18色谱柱(4.6 x 150 mm, 5 µ)。流动相由0.05%的四氢呋喃(THF)和水与乙腈按55:45的比例混合而成,流速为1.0 mL/min,进样量为10 µL。色谱柱温度保持在35°C,自动进样器在整个色谱运行过程中保持在15°C。洗脱液在250 nm波长下进行监测。
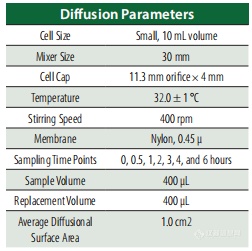
FDA的《半固体制剂放大生产和上市后变更指南》(SUPAC-SS)进行。垂直扩散池(VDC)的接收室填充了10 mL的0.5%醋酸溶液,溶剂为水、四氢呋喃和乙醇按55:15:30 V/V的比例混合,并保持在32±1°C;每个池子上安装了尼龙膜。大约30分钟后,细胞达到平衡,然后在膜上施加约400 mg的2% Crisaborole。为避免蒸发并保持产品完整性,供体室用玻璃盘覆盖。在测试期间,使用设置在400 rpm的磁力搅拌器持续搅拌接收液。
释放速率是使用Higuchi模型计算得出的,该模型假设测试条件完镁。考虑到由于替换导致的接收介质的明显稀释,每个时间点的浓度都是通过配备PDA检测器的RP-HPLC测定的。不同取样时间的接收介质中Crisaborole的浓度以及累计释放药物量是通过内部验证的Microsoft Excel电子表格计算得出的。释放速率对应于绘制的药物释放量(μg/cm²)与时间平方根(√t)的回归线斜率,并且受样本体积、细胞体积和细胞孔径的影响。因此,这些参数在设备资格认证过程中得到了验证。
如美国药典(USP)通用章节所述,使用统计方法计算了参考上市药物(RLD
)产品制剂(“已上市”)和每种Crisaborole测试制剂(“内部”)的释放速率,以计算测试/参考(T/R)比值。使用六个扩散池对两种产品做测试,因此共获得了36个T/R比值,并按从低到高的顺序进行排列。根据相关要求,从列出的T/R比值中确定90%置信区间(CI),其中第8个和第29个比值分别是下限和上限。当90% CI在75%–133.33%范围内时,认为产品等效。IVRT研究是根据FDA的SUPAC-SS指南[1]进行的。测试产品,即内部Crisaborole(2%)与参考产品Eucrisa(Crisaborole)2%进行了比较,如图1所示。
,将样品随机放置在垂直扩散池上作为测试(T)和参考(R)产品。将R和T的累积药物释放量分别绘制成时间平方根的函数图。由于常见的测试误差如气泡、膜缺陷和非正态分布的产量测量,使用了非参数统计技术来评估测试结果。由于在IVRT期间预计会出现一些异常值(例如,由于气泡形成),因此使用了对这类异常值存在较为抗性的非参数方法。如USP通用章节1724所建议,使用Mann-Whitney U检验来计算参考和测试产品斜率比的90%置信区间(CI)。八、
IVRT当RLD的Crisaborole 2%软膏(称为Eucrisa)与一种内部制造的Crisaborole(2%)作比较时,如表1所示。两种产品释放速率的比较表明它们之间有不一致性(图1)。在研究结束时,两种产品显示出类似的释放量;最初时间点数据的差异是导致两种产品轮廓不匹配的原因。尽管两种产品都含有2%的Crisaborole,但在辅料类型和数量以及Q3因素方面的差异可能会影响了研究结果。
非无菌半固体剂型指南以及USP通用章节的推荐,对自制产品和批准的Crisaborole RLD产品做了体外释放测试(IVRT)。自制的Crisaborole (2%)和RLD的IVRT研究结果未达到75%-133.33%的接受标准。通过比较仿制药,表明这些在所使用的分析测试方法下,它们的释放速率并不等同。这种不等同原因是仿制制剂与RLD在Q1/Q2上不同;可能根本原因是在它们的配方中使用了不一样的等级的聚合物。然而,在不同实验室获得的RLD样品的测试结果相互匹配,并且用50%、100%和150%标示量的2% Crisaborole自制产品的特异性符合方法特异性和灵敏度标准的接受标准。
方法非常有助于准确区分释放速率,这可能反映了产品性能的差异或相似性。此外,根据结果得出开发的IVRT
方法和使用的工具具有检测配方变化的强大能力。研究中获得的结果提供了证据,表明Phoenix RDS
设备和经过验证的测试方法有能力准确测定局部用药产品中Crisaborole的释放率。这两者的结合可靠地提供了有说服力的数据,这一些数据能够适用于生物豁免申请中。十一、参考

